
Liebe Freunde,
liebe Mitleser,
liebe Coronavirusinfizierte,
die nCoV-Pandemie wird weiter wüten - egal was die Medien
herausposaunen. Wir wollen die Zeit nutzen und versuchen zu verstehen,
wie möglicherweise das Virus unser Immunsystem lahmlegt und wie man
sinnvoll die Erkrankung behandeln kann und eventuelle Risikofaktoren für
einen fatalen Ausgang der Erkrankung minimieren kann. Eins vorweg -
tierexperimentelle Studien zur Pathophysiologie des nCoV-Virus liegen
bislang nicht vor, so dass in diesem Zusammenhang auf Studien
zurückgreifen sollten die ähnliche durch Viren erzeugte
Erkrankungsmuster aufweisen.
Hies es vor einigen Tagen noch, dass der virale Spike des S-Proteins
eine hohe Ähnlichkeit mit dem viralen Spike des gp120 des HIV1-Rezeptors
habe, so verdichten sich inzwischen die Hinweise, dass das nCoV-Virus
an die Wirtszelle, wie das SARS-Virus auch, über den Rezeptor für
Angiotensin-2 an die Wirtszelle andockt um danach sich via Endozytose in
das Zellinnere seines Wirtes einschleusen zu lassen. Ein Prozess der
vermutlich nach ca. 1-2 Stunden dann nach stattgehabter Fusion der Viren
mit der Wirtszelle zur deletären Freisetzung der viralen RNA im
Zellinneren führen dürfte.
Auf Grund dieser neuen Datenlage habe ich mein Modell zur Struktur
des viralen S-Proteins beim 2019 nCoV-Virus noch einmal überarbeitet.
Dieses sieht nun wie folgt aus:
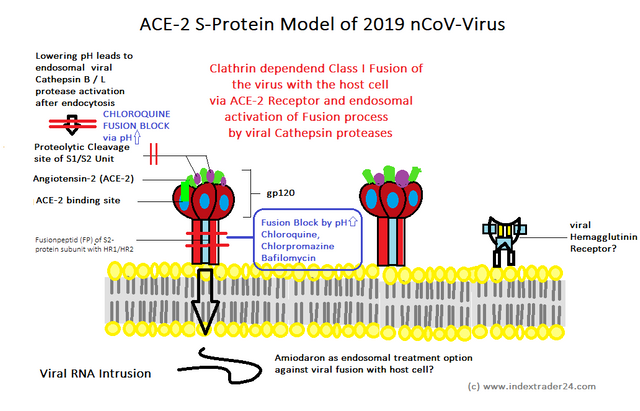
Die wichtigsten Änderungen, die ich nach meiner Literaturrecherche zu
den Coronaviren und deren Replikation vorgenommen habe, betreffen
hierbei dem Austausch des CD4 Rezeptors aus dem HIV1-Modell, gegen den
ACE-2 Rezeptor, wie er auch beim SARS-Coronavirus gefunden wird. Hieraus
ergeben sich umgehend neue Fragen im Hinblick auf die Therapie zur
Verbesserung der Überlebenschancen von nCoV-infizierten Patienten und es
stellt sich die Frage, ob die höhere Sterblichkeit der nCoV-Infizierten
Patienten die Folge einer ACE-Hemmertherapie, wie sie massenhaft
inzwischen in der inneren Medizin praktiziert wird um beispielsweise den
Blutdruck zu regulieren.
Diese Frage ist von zentraler Bedeutung, sofern meine Annahmen zur
viralen Pathophysiologie und dem oftmals anzutreffenden tödlichen
Lungenversagen zutreffen sollten. Denn es ist denkbar, dass die Gabe von
ACE-Hemmern die Überlebenschancen der Patienten verschlechtert und das
fehlende Achtsamkeit im Umgang mit ACE-Hemmern die Überlebensprognose
der Patienten verschlechtert. Diesen Gedanken zu Ende gedacht könnte je
nach Verordnungsverhalten der Ärzteschaft hinsichtlich der Gabe von ACE
Hemmern während der akuten symptomatischen Erkrankungsphase der
Patienten das Auftreten eines potentiell tödlichen Lungen- und
Nierenversagens sogar begünstigt werden, was dann auch die höhere
Sterblichkeit bei vor allem alten und multimorbiden (!) und vermutlich
auch mit ACE-Hemmern behandelten Patienten erklären würde.
Da das Renin-Angiotensin-System (RAS-Sytem) im Hinblick auf die
Pathophysiologie eines Lungenversagens (ARDS) im Rahmen der Behandlung
einer respiratorischen Coronavirusinfektion eine zentrale Rolle zu
spielen scheint, sollte dies im Hinblick auf mögliche Chancen für
innovative Therapieansätze, wie auch deren Nebenwirkungen, hin
untersucht werden. Wichtig erscheint mir dabei bestehende medikamentöse
Therapien, wie beispielsweise mit ACE-Hemmern, und deren Einsatz bei
Coronavirus Infizierten Patienten im Hinblick auf die Risiken eines
Lungenversagens und einer Exazerbation des Krankheitsbildes kritisch zu
beleuchten und ggf. je nach weiterer Entwicklung der zukünftigen
Datenlage einer sorgfältigen Überprüfung zu unterziehen.
Gehen hohe ACE Plasma-Spiegel mit verbesserten Überlebenschancen von Patienten mit einer viralen Pneumonie einher?
Von Patienten mit Lungenversagen wie beim H7N9 Virus wissen wir, dass
hohe ACE Serumspiegel als positiver Prädikator für das Überleben eines
schwerst erkrankten infizierten Patienten gewertet werden können.
Dies ist in der Logik der komplexen Interaktion zwischen Virus und
Wirtsorganismus durchaus auch nachvollziehbar. So wissen wir inzwischen,
dass Angiotensin 2, das als Enzymprodukt durch die Aktivität des
ACE-Enzyms im Organismus entsteht, die dendritischen Zellen des
Abwehrsystems als hochpotente Aktivatoren des körpereigenen Immunsystems
via ACE-2 Rezeptor zur Ausschüttung von Zytokinen anregen, sprich
Botenstoffe freisetzen, welche der Bekämpfung viraler und bakterieller
Eindringlinge entgegen wirken.
Angiotensin 2 (ACE2) moduliert somit unter dem Einfluss des
Angiotensin-Converting-Enzyms (ACE) nicht nur hämodynamische Parameter
im Organismus auf verschiedenen Ebenen im Zusammenspiel mit dem
Renin-Angiotensin System, sondern auch die angeborene und adaptive
Komponente des menschlichen Immunsystems.
Dabei wusste man lange nicht, woher das ACE im Blutplasma stammte,
welches für die Bildung von ACE2 im Körper sorgt. Inzwischen ist jedoch
bekannt, dass rund 80 Prozent des ACE-Vorkommens im Blutserum aus der
Lunge zu stammen scheint - genauer genommen aus den Lungenbläschen - den
Alveolen - also genau aus den Strukturen, welche fataler Weise das
nCoV-Virus, wie auch das SARS-Coronavirus zu befallen scheinen.
Es liegt auf der Hand, dass das nCoV-Virus damit die
Hauptproduktionsstätte des für die körpereigenen Abwehr so wichtigen
ACE-Enzyms lahmlegt und es ist aus Studien mit Rauchbelastung bekannt,
dass bereits 30 Minuten nach Rauchgasexposition und damit einhergehender
Lungenschädigung der Alveolen es zu massiven Abfällen der
Serum-ACE-Spiegel kommt, welche beispielsweise bei Verbrennungsopfern
zum gehäuften Auftreten komplizierter Infektionen zu führen scheint.
Ich will an dieser Stelle nicht auch noch die Thematik durch
Nikotinwirkung auf ACE-2 Rezeptoren im Zentralnervensystem weiter
eingehen, da dies die eh komplexen Wechselwirkungsmechanismen nur noch
verkomplizieren würde. Nur soviel sei angemerkt:
ACE2 schützt bei Coronavirus-Infektionen offenbar vor der Ausbildung eines fatalen Lungenversagens (engl. acute respiratory distress syndrome - kurz ARDS)
Allerdings gibt es auch Hinweise tierexperimenteller Art an Mäusen,
dass die Bindung von ACE2 an den AT1-Rezeptor (sogenannte
AC2-AT1-Aktivierung) zu einer Verschlechterung der Lungenpathologie beim
Lungenversagen führt, die auf eine Verstärkung der Entzündungsreaktion
im Lungengewebe zurückgeführt werden kann, während zugleich jedoch die
Virusreplikation im Influenzaversuch mit H7N9 Viren, gehemmt wurde.
Ist die Infusion von gentechnischen hergestelltem ACE2 bei Lungenversagen sinnvoll?
Wenn die Gabe von gentechnisch hergestellten rekombinanten humanen ACE2 (rhACE2) bei der Behandlung des Lungenversagens
bei nCoV-Patienten und anderen Viren, die sich des ACE2-Rezeptors
bedienen um das Immunsystem des Wirtes zu unterdrücken, so muss bei dem
Ziel der Virusbekämpfung mittels Gabe von rhACE-2 im off-label use die
Möglichkeit einer Verschlechterung des Lungenversagens diskutiert oder
zumindest als mögliches Risiko für einen fatalen Ausgang der Erkrankung
in Erwägung gezogen werden und gegen den Nutzen einer Virusinhibition
abgewogen werden.
Auch wenn eine protektive Rolle bei der Gabe von rekombinanten hACE2
bei der Behandlung möglich erscheint, welche zudem theoretisch den
viralen Befall von Lungenepithelzellen in den Lungenbläschen, reduzieren
kann, in dem die Fusion von Viruspartikeln mit den ACE2 Rezeptor von
dendritischen Abwehrzellen bzw. mit Makrophagen kompetitiv gehemmt wird,
so ist dabei denoch zu bedenken, dass es - so vermute ich - durch eine
verstärkte Ausschüttung an Zytokinen aus dem dann aktivierten
Immunsystem zu einer forcierten Gewebeschädigung im Zielorgan - in
diesem Fall der Lunge kommen kann.
Daher sollte meines Erachtens vor der Gabe von rekombinanten humanen
ACE2 im Rahmen klinischer Prüfungen und Studien beim akuten
Lungenversagen ein mehrstufiges Vorgehen in Betracht gezogen werden, in
dem zunächst überprüft wird, ob durch iatrogene - also vom Arzt
verursachte - Begleittherapie mit ACE Hemmern, die pharmakoökonomische
Relevanz einen hohen Stellenwert in der Pharmaindustrie hat, für die
Dauer der Erkrankung ausgesetzt wird und ggf. nach Gabe von viralen
Fusionsinhitoren, erst bei fehlender Besserung (in standby Bereitschaft einer extrakorporalem Membran Oxigenierung (ECMO) die Gabe von rekombinanten ACE2)
eingeleitet wird, da nach Einleitung einer rACE-2 Gabe ich zunächst mit
einem forcierten Lungenversagen des so behandelten Patienten - auf
Basis tierexperimenteller Daten - rechne, welches sich vermutlich erst
nach zeitlicher Latenz durch die ACE-2 induzierte kompetetive Hemmung
der Virusvermehrung des nCoV-Coronavirus in der Lage wäre sich zu
bessern.
SEND with LOVE!
Peace!
Quellen:
[1.] Wirkung von ACE-Hemmern
[2.] Angiotensin2 und Immunsystem Artikel in Nature
[3.] ACE2 und Lungenversagen Studie zu ARDS
[4.] ACE2 induzierte Schädigung bei H7N9 Infektionen
[5] Rekombinantes humanes Angiotensin 2 zur Therapie des viralen Lungenversagens bei ARDS
Posted via Steemleo
Keine Kommentare:
Kommentar veröffentlichen